|
Látkové množstvo
Medzi základné fyzikálne veličiny je zaradená i veličina, ktorá sa používa predovšetkým v chémii. Je to látkové množstvo. Látkovým množstvám n rozumieme podiel nejakého počtu N molekúl homogénnej látky a Avogadrovej konštanty L. Hlavnou jednotkou látkového množstva je 1 mol. Mol je jednotka pomerne nová, bola definovaná v súvislosti so zavedením SI. Čo je teda mol? 1 mol je jednotka látkového množstva, ktorá obsahuje práve toľko elementárnych jedincou, ako je atómou v 0,012 kg uhlíka. Správne pochopenie pojmu látkové množstvo a mol je veľmi obtiažne a vyžaduje to pomerne značné znalosti chémie. chémie.
Atómy a molekuly, prvky a zlúčeniny       
I chemicky čisté látky sa môžu skladať z iných, jednoduchších látok. Tak napr. nám dobre známa voda je zložená z vodíka a kyslíka. Takéto chemicky čisté látky zložené z látok jednoduchších sa nazývajú zlúčeniny. Roskladom zlúčenín získame jednoduchšie : prvky. Ľuďom však poznanie látok nestačilo. Pýtali sa sami seba či sa nedá prvok ďalej rozložiť. Napr.: Demokritos a ďaľší fylozofovia si hmotu predstavovali ako zhluk maličkých častíc. Hovorili im atómy.
Ešte raz o atóme                  
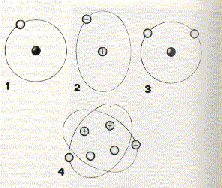
Prvok je látka s atómamy rovnakého druhu. Chemicky rovnaké atómy sa však pri niektorých fyzikálnych dejoch nemusia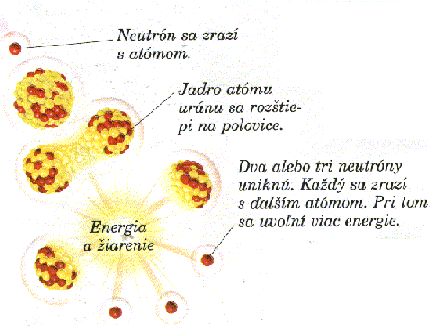 chovať rovnako.Prvok teda môže vo svojich molekuláchobsahovať chemicky rovnaké, ale hmotnosťou odlišné atómy. Keby sme si potom dali vždy na stranu atómu s rovnakými chemickými vlastnosťami a zároveň s rovnakými hmotnosťami, dostali by sme skupinu, ktorú nazývame izotopy(alebo nuklidy). Názov izotopu obsahuje názov prvku, s ktrorym sa zhoduje chemickými vlastnosťami, a číslo, ktoré vyjadruje hmotnosť atómudaného izotopu.Niekedy majú izotopy jedného prvku i svoje zvláštne názvy-napr. izotop vodíka 2H sa nazýva deuterium, 3H trítium. Na chvíľu však predpokladajme, že hmotnosť atómu jedného prvku je rovnaká. Ako veľká je hmotnosť nejakého prvku? Už vieme,že atom je veľmi malá častica hmoty. Jej hmotnosť je teda tiež nepredstavitelne malá. O tom nás môže presvedčiť napr. číslo 0,000 000 000 000 000 000 000 001 67 g (je to 1,67 kvadriliontin gramu), čo je hmotnosť atómu vodíka. chovať rovnako.Prvok teda môže vo svojich molekuláchobsahovať chemicky rovnaké, ale hmotnosťou odlišné atómy. Keby sme si potom dali vždy na stranu atómu s rovnakými chemickými vlastnosťami a zároveň s rovnakými hmotnosťami, dostali by sme skupinu, ktorú nazývame izotopy(alebo nuklidy). Názov izotopu obsahuje názov prvku, s ktrorym sa zhoduje chemickými vlastnosťami, a číslo, ktoré vyjadruje hmotnosť atómudaného izotopu.Niekedy majú izotopy jedného prvku i svoje zvláštne názvy-napr. izotop vodíka 2H sa nazýva deuterium, 3H trítium. Na chvíľu však predpokladajme, že hmotnosť atómu jedného prvku je rovnaká. Ako veľká je hmotnosť nejakého prvku? Už vieme,že atom je veľmi malá častica hmoty. Jej hmotnosť je teda tiež nepredstavitelne malá. O tom nás môže presvedčiť napr. číslo 0,000 000 000 000 000 000 000 001 67 g (je to 1,67 kvadriliontin gramu), čo je hmotnosť atómu vodíka.
V chémií bola zavedená miesto skutočných hmotností pomerné čísla-relatívne atómové hmotnosti. Za základ relatívnych atómových hmotností bola zvolená 1/12 hmotnostiatómu izotopu uhlíka 612C. Číslo na hore je hmotnostné čísl, číslo dole je protónové.
 Ďalšou veličinou, s ktorou prídeme v chémii často do styku je molárna hmotnosť látky a molárny objem látky. Molárna hmotnosť látky nám udáva úhrnnú hmotnosť molekúl v gramoch pripadajúcich na mol látky. Jednotkou molárnej hmotnosti je g.mol-1. Molárna hmotnosť príslušnej látky v gramoch na 1 mol ma rovnakúčíselnú hodnotuako jej relatívna molekulová hmotnosť. Obdobou molárnej hmotnosti je molárny objem. Hodnota ejto veličiny v m3.mol-1 nás informuje o tom, aký objem v m3 pripadá za daných podmienok v sústave či telese na 1 mol látky. Molárny objem tiež slúži na prepočet určitého objemového množstva látky na molárne množstvo a naopak.
Ďalšou veličinou, s ktorou prídeme v chémii často do styku je molárna hmotnosť látky a molárny objem látky. Molárna hmotnosť látky nám udáva úhrnnú hmotnosť molekúl v gramoch pripadajúcich na mol látky. Jednotkou molárnej hmotnosti je g.mol-1. Molárna hmotnosť príslušnej látky v gramoch na 1 mol ma rovnakúčíselnú hodnotuako jej relatívna molekulová hmotnosť. Obdobou molárnej hmotnosti je molárny objem. Hodnota ejto veličiny v m3.mol-1 nás informuje o tom, aký objem v m3 pripadá za daných podmienok v sústave či telese na 1 mol látky. Molárny objem tiež slúži na prepočet určitého objemového množstva látky na molárne množstvo a naopak.
|
 Látkové množstvo
Látkové množstvo
 Atómy a molekuly, prvky a zlúčeniny
Atómy a molekuly, prvky a zlúčeniny
 Ešte raz o atóme
Ešte raz o atóme
 Látkové množstvo
Látkové množstvo
 Atómy a molekuly, prvky a zlúčeniny
Atómy a molekuly, prvky a zlúčeniny
 Ešte raz o atóme
Ešte raz o atóme